оксиди азоту 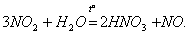
В оксидах ступінь окислення азоту змінюється від +1 до +5. Оксиди N2О і NO - безбарвні гази, оксид азот (IV) NO2 - бурий газ, який отримав в промисловості назва «лисячий хвіст». Оксид азоту (III) N2О3 - синя рідина, оксид азоту (V) N2O5 при звичайних умовах - прозорі безбарвні кристали. Часто використовується тривіальне назва оксиду азоту (I) ...
оксиди фосфору

Фосфорний ангідрид Р2О5 ( «найпростіша» формула) є найбільш стабільним оксидом фосфору при звичайних умовах. Це - тверде білу речовину складу Р4О10. Фосфористий ангідрид описується найпростішої формулою Р2O3 і істинною формулою Р4О6. Показано, що фосфор в Р4О6 координаційно насичений, і тому є нестійким. Взаємодія Р4О6 з гарячою водою призводить до диспропорціонування Р4О6 + 6Н2О = РН3 ↑ + ЗН3РО4; Газоподібний НСl розкладає Р4О6: Р4О6 + 6НСl = 2Н3РО3 + 2РСl3. Р4О10 активно взаємодіє з водою, а також забирає її від інших з'єднань, утворюючи в залежності від умов, або метафосфорную НРО3, або ортофосфорну Н3РО4, або пірофосфорна Н4Р2О7 кислоти. Саме тому Р4О10 широко використовується як осушувач різних речовин від парів води.
Азотна кислота

Азотна кислота HNO3 в чистому вигляді - безбарвна рідина з різким задушливим запахом. У невеликих кількостях вона утворюється при грозових розрядах і присутній в дощовій воді. Під дією світла азотна кислота частково розкладається з виділенням NО2 і за Рахунок цього набуває світло-бурий колір: 4НNО3 = 4NО2 + 2Н2О + О2. Азотна кислота належить до числа ...
розкладання нітратів

При нагріванні твердих нітратів всі вони розкладаються з виділенням кисню (винятком є нітрат амонію), при цьому їх можна розділити на чотири групи. Першу групу складають нітрати лужних металів, які при нагріванні розкладаються на нітрити і кисень: 2КNО3 = 2КNО2 + О2 ↑. Другу групу становить більшість нітратів (від лужноземельних металів до міді включно), що розкладаються на оксид металу, NО2 і кисень: 2Сu (NО3) 2 = 2СuО + 4NО2 + O2, Третю групу складають нітрати найбільш важких металів (АgNО3 і Нg (NО3) 2 ), що розкладаються до вільного металу, NО2 і кисню: Hg (NО3) 2 = Нg + 2NО2 + О2, Четверту «групу» становить нітрат амонію: NН4NО3 = N2О + 2Н2O.
азотистая кислота
Азотистая кислота НNО2 належить до слабких кислот (К = 6.10-4 при 25 ° С), нестійка і відома лише в розведених розчинах, в яких здійснюється рівновагу 2НNО2 NО + NО2 + Н2О. Нітрити на відміну від самої кислоти стійкі навіть при нагріванні. Винятком є кристалічний нітрит амонію, який при нагріванні розкладається на вільний азот і воду.
фосфорні кислоти

З трьох фосфорних кислот найбільше практичне значення має ортофосфорна кислота Н3РО4 (часто її називають просто фосфорною) - біла тверда речовина, добре розчинна у воді. У водному розчині вона дисоціює ступінчасто. Як триосновна, фосфорна кислота утворює три типи солей: дигідрофосфат (NаН2РО4); гідрофосфат (Nа2НРО4); фосфати (Na3РО4). Все Дигідрофосфат розчинні у воді. З гидрофосфата і фосфатів у воді розчиняються тільки солі лужних металів і амонію. Солі фосфорної кислоти є цінними мінеральними добривами. Найбільш поширені серед них - суперфосфат, преципітат і фосфоритне борошно. Простий суперфосфат - суміш дигідрофосфату кальцію Са (Н2РО4) 2 і «баласту» СаSО4. Його отримують, обробляючи фосфорити і апатити сірчаною кислотою. При обробці мінеральних фосфатів фосфорною кислотою отримують подвійний суперфосфат Са (Н2РО4) 2. При гасінні фосфорної кислоти вапном отримують преципітат СаНРО4.2Н2О. Важливе значення мають складні добрива (тобто містять одночасно азот і фосфор; або азот, фосфор і калій). З них найбільш відомий амофос - суміш NН4Н2РО4 і (NН4) 2НРО4.

