Критичний стан речовини
Подібність властивостей ненасичених парів і газів наштовхнуло М. Фарадея на припущення: чи не є гази ненасиченими парами відповідних рідин? Якщо припущення вірне, то можна спробувати зробити їх насиченими і скондесувати. Дійсно, стисненням вдалося зробити насиченими багато гази, крім шести, які М. Фарадей назвав "постійними": це азот, водень, повітря, гелій, кисень, оксид вуглецю CO.
Щоб зрозуміти, в чому тут справа, вивчимо докладніше ізотермічний процес стиснення (розширення) пара. Ми бачили, що ізотерма реального газу відрізняється від ізотерми ідеального газу наявністю горизонтальної ділянки, відповідного області існування двофазної системи: насиченої пари і рідини.
Якщо проводити досліди при більш високих температурах (T 1 <T 2 <T 3 <T k <T 4), то можна виявити закономірність, загальну для всіх речовин (рис. 1).
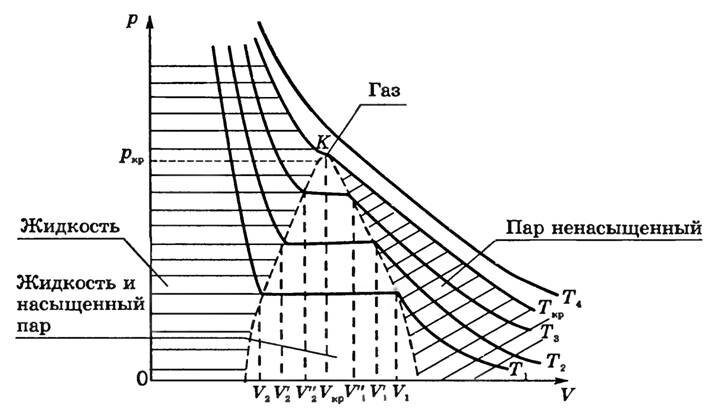
Мал. 1
По-перше, чим вище температура, тим менше обсяг, при якому починається конденсація газу: V 1> V '1> V' '1, якщо T 1 <T 2 <T 3.
По-друге, чим вище температура, тим більше обсяг, яку він обіймав рідиною після того, як весь пар конденсується:
V
2 <V '2 <V' '2.
Отже, довжина прямолінійного ділянки ізотерми з ростом температури зменшується.
Це легко пояснити: з ростом Τ тиск насиченої пари швидко наростає, і для того, щоб тиск ненасиченого пара зрівнялося з тиском насиченої, необхідно зменшення обсягу. Причина збільшення обсягу V 2 - в тепловому розширенні рідини при нагріванні. Так як обсяг V 1 зменшується, то щільність парів при збільшенні температури збільшується; збільшення обсягу V 2 свідчить про зменшення щільності рідини. Це означає, що відмінність між рідиною і її насиченим паром в процесі такого нагрівання згладжується і при досить високій температурі повинно зникнути зовсім.
Д. Менделєєв встановив, що для кожної рідини повинна існувати така температура, яка експериментально вперше була встановлена для багатьох речовин Т. Ендрюсом і носить назву критичної температури.
Критична температура T кр - це така температура, при якій щільність рідини і щільність її насиченої пари стають однаковими (рис. 2).
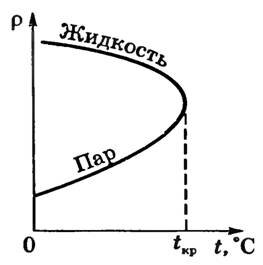
Мал. 2
На ізотермах при Т = T кр горизонтальну ділянку перетворюється в точку перегину До.
Тиск насиченої пари якої-небудь речовини при його критичній температурі називається критичним тиском p кр. Воно є найбільшим можливим тиском насичених парів речовини.
Обсяг, який займає речовина при p кр і t кр, називається критичним об'ємом м V кр. Це найбільший обсяг, який може займати наявна маса речовини в рідкому стані.
При критичній температурі відмінність між газом і рідиною зникає, і тому питома теплота пароутворення стає рівною нулю.
Сукупність точок, відповідних краях горизонтальної ділянки ізотерм (див. Рис. 1), виділяє в площині pV області існування двофазної системи і відокремлює її від областей однофазних станів речовини. Прикордонна крива області двофазних станів з боку великих значень обсягу описує стан насиченої пари і одночасно представляє собою криву конденсації (починається конденсація пара при ізотермічному стисканні). Прикордонна крива з боку менших обсягів являє собою криву, на якій закінчується конденсація при стисненні насиченої пари і починається випаровування рідини при ізотермічному розширенні. Її називають кривою випаровування.
Існування критичної температури речовини пояснює, чому при звичайних температурах одні речовини можуть бути як рідкими, так і газоподібними, а інші залишаються газами.
Вище критичної температури рідина не утворюється навіть при дуже високому тиску.
Причина полягає в тому, що тут інтенсивність теплового руху молекул виявляється настільки великий, що навіть при відносно щільною їх упаковці, причиною чого стали масові тиском, молекулярні сили не можуть забезпечити створення навіть ближнього, а тим більше далекого порядку.
Таким чином, видно, що принципової різниці між газом і парою немає. Зазвичай газом називають речовина в газоподібному стані, коли його температура вище критичної. Пором називають також речовина в газоподібному стані, але коли його температура нижче критичної. Пар можна перевести в рідину одним тільки збільшенням тиску, а газ не можна.
В даний час все гази переведені в рідкий стан при дуже низьких температурах. Останнім в 1908 р переведений гелій (t кр = -269 ° С).
література
Аксеновіч Л. А. Фізика в середній школі: Теорія. Завдання. Тести: Учеб. посібник для установ, що забезпечують отримання заг. середовищ, освіти / Л. А. Аксеновіч, Н.Н.Ракіна, К. С. Фаріно; Під ред. К. С. Фаріно. - Мн .: Адукация i вихаванне, 2004. - C. 176-178.
Фарадея на припущення: чи не є гази ненасиченими парами відповідних рідин?
